2.3.1 จำนวนอิเล็กตรอนในแต่ละระดับพลังงาน
จากการศึกษาแบบจำลองอะตอม ทำให้ทราบว่าอะตอมประกอบด้วยโปรตอนและนิวตรอน อยู่รวมกันในนิวเคลียส โดยมีอิเล็กตรอนเคลื่อนที่อยู่รอบ ๆ และอยู่ในระดับพลังงานต่างกัน อิเล็กตรอน เหล่านั้นอยู่กันอย่างไรและในแต่ละระดับพลังงานจะมีจำ นวนอิเล็กตรอนสูงสุดเท่าใด ให้นักเรียน พิจารณาข้อมูลแสดงการจัดเรียงอิเล็กตรอนของธาตุบางธาตุดังตาราง 2.5
เมื่อพิจารณาข้อมูลในตาราง 2.5 จะพบว่าจำ นวนอิเล็กตรอนในระดับพลังงานที่ 1 มีได้มาก ที่สุด 2 อิเล็กตรอน ระดับพลังงานที่ 2 มีได้มากที่สุด 8 อิเล็กตรอน สำ หรับระดับพลังงานที่ 3 นั้น จากการสืบค้นข้อมูลเพิ่มเติมทำ ให้ทราบว่ามีได้มากที่สุด 18 อิเล็กตรอน นั่นคือ จำ นวนอิเล็กตรอน มากที่สุดที่มีได้ในแต่ละระดับพลังงานจะมีค่าเท่ากับ 2n² เมื่อ n คือ ตัวเลขแสดงระดับพลังงาน ถ้าพิจารณาตามหลัก 2n² การจัดเรียงอิเล็กตรอนของธาตุ K และ Ca ควรเป็น 2 8 9 และ 2 8 10 ตามลำ ดับ เนื่องจากในระดับพลังงานที่ 3 ควรมีอิเล็กตรอนได้สูงสุดถึง 18 อิเล็กตรอน แต่ จากการศึกษาพบว่าการจัดเรียงอิเล็กตรอนของธาตุ K และ Ca เป็น 2 8 8 1 และ 2 8 8 2 ตาม ลำ ดับ ซึ่งหมายความว่าอิเล็กตรอนในระดับพลังงานที่ 3 ของทั้งสองธาตุนี้มีเพียง 8 อิเล็กตรอน และ อิเล็กตรอนที่เพิ่มมาอีก 1 และ 2 อิเล็กตรอนนั้นเข้าไปอยู่ในระดับพลังงานที่ 4 ทำ ให้ระดับพลังงานที่ 3 มีอิเล็กตรอนไม่ครบ 18 ข้อมูลดังกล่าวนี้จะได้ศึกษาต่อไป
2.3.2 ระดับพลังงานหลัก และระดับพลังงานย่อย
นักเรียนทราบมาแล้วว่าโบร์เสนอแบบจำลองโดยใช้ข้อมูลเกี่ยวกับเส้นสเปกตรัมของ ไฮโดรเจนซึ่งแสดงให้เห็นว่าอะตอมของไฮโดรเจนมีพลังงานหลายระดับและความแตกต่างระหว่าง พลังงานของแต่ละระดับที่อยู่ถัดไปก็ไม่เท่ากัน โดยความแตกต่างของพลังงานจะมีค่าน้อยลง เมื่อมี ระดับพลังงานสูงขึ้น การอธิบายเกี่ยวกับเส้นสเปกตรัมของโบร์ได้จุดประกายให้นักวิทยาศาสตร์หลายคนเกิดความ สนใจและศึกษาเกี่ยวกับเส้นสเปกตรัมมากขึ้น และพบว่าเส้นสเปกตรัมของไฮโดรเจนที่เปล่งแสง ออกมาและมองเห็นเป็น 1 เส้นนั้นแท้จริงแล้วประกอบด้วยเส้นสเปกตรัมมากกว่า 1 เส้น ซึ่งนำ ไปสู่ข้อสรุปที่ว่า เส้นสเปกตรัมที่เกิดขึ้น นอกจากเป็นการคายพลังงานของอิเล็กตรอนจากระดับพลังงานหลัก (principle energy level หรือ shell) ซึ่งแทนด้วย n แล้ว ยังเป็นการคายพลังงานของอิเล็กตรอนจาก ระดับพลังงานย่อย (energy sublevel หรือ subshell) ของแต่ละระดับพลังงานหลักอีกด้วย
นักวิทยาศาสตร์ได้กำ หนดระดับพลังงานย่อยเป็นตัวอักษร s p d และ f ตามลำ ดับ แนวคิด ดังกล่าวนี้สามารถนำ มาอธิบายสเปกตรัมของธาตุที่มีมากกว่า 1 อิเล็กตรอนได้ และจากการศึกษา เพิ่มเติมพบว่าจำ นวนระดับพลังงานย่อยที่เป็นไปได้ในแต่ละระดับพลังงานหลักที่ 1 – 4 เป็นดังนี้
 |
| รูป 2.15 แผนภาพระดับพลังงานของอะตอมที่มีหลายอิเล็กตรอน |
จากรูป 2.15 สามารถสรุปได้ว่า
ระดับพลังงานหลักที่ 1 (n = 1) มี1 ระดับพลังงานย่อยคือ s
ระดับพลังงานหลักที่ 2 (n = 2) มี2 ระดับพลังงานย่อยคือ s p
ระดับพลังงานหลักที่ 3 (n = 3) มี3 ระดับพลังงานย่อยคือ s p d
ระดับพลังงานหลักที่ 4 (n = 4) มี4 ระดับพลังงานย่อยคือ s p d f
2.3.3 ออร์บิทัล
เนื่องจากอิเล็กตรอนมีการเคลื่อนที่ตลอดเวลา ความหนาแน่นของกลุ่มหมอกอิเล็กตรอนจึงอยู่ ในรูปของโอกาสที่จะพบอิเล็กตรอนซึ่งมีอาณาเขตและรูปร่างใน 3 มิติแตกต่างกัน บริเวณรอบนิวเคลียส ซึ่งมีโอกาสที่จะพบอิเล็กตรอนและมีพลังงานเฉพาะนี้เรียกว่าออร์บิทัล (orbital) จากศึกษาพบว่าจำ นวน ออร์บิทัลในแต่ละระดับพลังงานย่อยมีค่าแตกต่างกันซึ่งสามารถสรุปได้ดังนี้
ระดับพลังงานย่อย s มี 1 ออร์บิทัล
ระดับพลังงานย่อย p มี 3 ออร์บิทัล
ระดับพลังงานย่อย d มี 5 ออร์บิทัล
ระดับพลังงานย่อย f มี 7 ออร์บิทัล
จากรูป 2.15 ถ้าเขียนเป็นแผนผังโดยพิจารณาออร์บิทัลของแต่ละระดับพลังงานย่อยอาจเขียน แสดงได้ดังรูป 2.16
 |
| รูป 2.16 |
จำนวนอิเล็กตรอนสูงสุดในออร์บิทัลที่อยู่ในระดับพลังงานย่อย s p d และ f สามารถพิจารณาจากข้อมูลในตาราง 2.6
จากตาราง 2.6 จะเห็นว่าจำ นวนอิเล็กตรอนสูงสุดในระดับพลังงานย่อย s p d และ f มีค่าเท่ากับ 2 6 10 และ 14 ตามลำ ดับ แต่เนื่องจากพลังงานย่อย s p d และ f มี1 3 5 และ 7 ออร์บิทัลตามลำ ดับ แสดงว่า 1 ออร์บิทัลสามารถบรรจุอิเล็กตรอนได้2 อิเล็กตรอน
2.3.4 หลักการจัดเรียงอิเล็กตรอนในอะตอม
การจัดเรียงอิเล็กตรอนของอะตอมหนึ่ง ๆ ให้พิจารณาตาม หลักอาฟบาว (Aufbau principle) ซึ่งเกี่ยวข้องกับลำ ดับพลังงานของแต่ละออร์บิทัล กล่าวคือการบรรจุอิเล็กตรอนต้องบรรจุในออร์บิทัล ที่มีพลังงานต่ำ สุดและว่างอยู่ก่อนเสมอ ดังรูป 2.17 นั่นคือเริ่มจาก 1s 2s 2p 3s ... ตามลำ ดับ เพราะจะทำ ให้พลังงานรวมทั้งหมดมีค่าต่ำ ที่สุดและอะตอมมีความเสถียรที่สุด
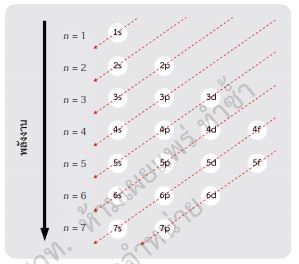 |
| รูป 2.17 แผนภาพแสดงลำดับการบรรจุอิเล็กตรอนในออร์บิทัลต่าง ๆ |
จากแผนภาพสามารถเรียงลำ ดับพลังงานได้ดังนี้
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p …
ไฮโดรเจนอะตอมซึ่งมี1 อิเล็กตรอน สามารถเขียนสัญลักษณ์แสดงการจัดเรียงอิเล็กตรอนได้ เป็น 1s¹ โดยมีความหมายดังนี้
 |
| รูป 2.18 สัญลักษณ์แสดงการจัดเรียงอิเล็กตรอนของไฮโดรเจนอะตอม |
สำหรับธาตุHe Li Be B C N O F Ne Na และ Mg ซึ่งมีอิเล็กตรอน 2 3 4 5 6 7 8 9 10 11 และ 12 ตามลำ ดับ สามารถเขียนสัญลักษณ์แสดงการจัดเรียงอิเล็กตรอนแบบเต็ม และแบบย่อโดยเขียนแก๊สมีสกุลในวงเล็บแทนการจัดเรียงอิเล็กตรอนของแก๊สมีสกุลในชั้นถัดเข้ามา และแสดงการจัดเรียงอิเล็กตรอนเฉพาะชั้นนอกสุด ดังตาราง 2.7
อิเล็กตรอนที่อยู่ในระดับพลังงานหลักสูงสุดหรือชั้นนอกสุดของอะตอมเรียกว่า เวเลนซ์อิเล็กตรอน (valence electron) เช่น ธาตุเบริลเลียมมีการจัดเรียงอิเล็กตรอนเป็น 1s²2s² จึงมีจำนวนเวเลนซ์ อิเล็กตรอนเท่ากับ 2 ส่วนฟลูออรีนมีการจัดเรียงอิเล็กตรอนเป็น 1s²2s²2p⁵ จึงมีจำนวนเวเลนซ์ อิเล็กตรอนเท่ากับ 7
การบรรจุอิเล็กตรอนตามลำ ดับระดับพลังงานโดยอาศัยแผนภาพตามหลักอาฟบาวดังที่ กล่าวมาแล้ว มีบางธาตุที่การบรรจุอิเล็กตรอนในระดับพลังงานย่อยไม่เป็นไปตามหลักการนั้น เช่น
ธาตุ Cr เลขอะตอม 24 แสดงการบรรจุอิเล็กตรอนในออร์บิทัลต่าง ๆ ได้ดังนี้
1s² 2s² 2p⁶ 3s² 3p⁶ 4s¹ 3d⁵ ไม่ใช่ 4s² 3d⁴
ธาตุCu มีเลขอะตอม 29 แสดงการบรรจุอิเล็กตรอนในออร์บิทัลต่าง ๆ ได้ดังนี้
1s² 2s² 2p⁶ 3s² 3p⁶ 4s¹ 3d¹⁰ ไม่ใช่ 4s² 3d⁹
ธาตุที่ได้รับหรือเสียอิเล็กตรอนสามารถเขียนการจัดเรียงอิเล็กตรอนได้ดังนี้
1. กรณีที่ธาตุได้รับอิเล็กตรอน ให้บรรจุอิเล็กตรอนปกติรวมกับอิเล็กตรอนที่รับเข้ามาตามลำดับระดับพลังงานโดยอาศัยแผนภาพตามหลักอาฟบาว เช่น
N : 1s² 2s² 2p³
N^3- : 1s² 2s² 2p⁶ (รับเพิ่ม 3 อิเล็กตรอน)
Cl : 1s² 2s² 2p⁶ 3s² 3p⁵
Cl^- : 1s² 2s² 2p⁶ 3s² 3p⁶ (รับเพิ่ม 1 อิเล็กตรอน)
2. กรณีที่ธาตุเสียอิเล็กตรอน ให้บรรจุอิเล็กตรอนตามปกติก่อน จากนั้นจึงนำ อิเล็กตรอนที่ อยู่ชั้นนอกสุดออก เช่น
Al : 1s² 2s² 2p⁶ 3s² 3p¹
Al^3+ : 1s² 2s² 2p⁶ (เสีย 3 อิเล็กตรอน)
Fe : 1s² 2s² 2p⁶ 3s² 3p⁶ 4s² 3d⁶
Fe^2+ : 1s² 2s² 2p⁶ 3s² 3p⁶ 3d⁶ ไม่ใช่ 1s² 2s² 2p⁶ 3s² 3p⁶ 4s² 3d⁴ (เสีย 2 อิเล็กตรอน)







ไม่มีความคิดเห็น:
แสดงความคิดเห็น